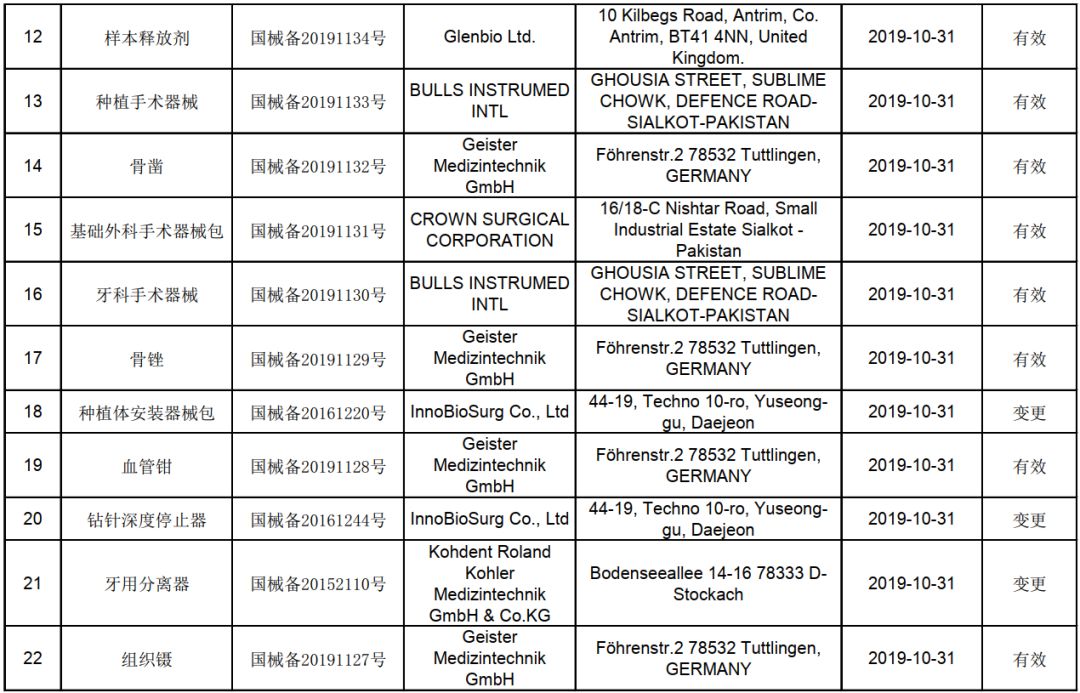
在国家对医疗器械实行分类管理、分级审批的监管框架下,第一类医疗器械因其风险程度低,实行产品备案管理,相较于第二、三类医疗器械的注册审批,流程已大为简化。对于在北京地区从事国产第一类医疗器械生产的企业而言,理解和掌握备案制的核心要求与流程,是实现产品快速上市的关键。以下是一份清晰的快速注册(备案)指南。
一、核心前提:准确的产品分类判定
快速注册的第一步,也是最重要的一步,是确保您的产品确实属于“第一类医疗器械”。企业需依据国家药品监督管理局发布的《第一类医疗器械产品目录》和《医疗器械分类规则》进行严谨判定。
- 自查目录:核对产品是否在目录内,并确认其管理类别为“I类”。
- 关注动态:目录会动态调整,需关注NMPA最新通告,避免因分类调整导致备案路径错误。
- 存疑即询:若无法确定,应向北京市药品监督管理局(以下简称“北京市药监局”)或专业服务机构咨询,必要时申请分类界定。分类错误将直接导致备案失败或后续监管风险。
二、备案主体与资质要求
备案人应当是北京市辖区内的医疗器械生产企业(即注册地址和生产地址位于北京),并且需取得有效的《营业执照》,经营范围应包含医疗器械生产、销售等相关内容。
三、快速备案流程与核心材料准备
北京地区国产第一类医疗器械备案全程通过 “北京市药品监督管理局企业服务平台” 在线办理,实现无纸化、高效化。
主要流程步骤:
1. 平台登录与信息维护:企业使用法人一证通登录平台,完善企业基本信息。
2. 产品备案信息填报:在线填写《第一类医疗器械备案表》及相关信息。这是备案的核心,务必准确、完整。
3. 电子材料提交:按要求上传以下关键材料的清晰扫描件或电子文件:
- 备案表:系统生成后签章上传。
- 安全风险分析报告:虽为I类产品,仍需对已知风险进行分析并陈述控制措施。
- 产品技术要求:按照《医疗器械产品技术要求编写指导原则》制定,内容应清晰、明确,包含性能指标、检验方法等。
- 产品检验报告:可以是备案人的自检报告,或委托有资质的检验机构出具的检验报告。报告结论需符合产品技术要求。
- 临床评价资料:第一类医疗器械通常可豁免临床评价,但需提交 “豁免临床评价说明” ,声明产品符合《免于临床评价医疗器械目录》或通过同品种比对等方式完成评价。
- 产品说明书及最小销售单元标签设计样稿:内容与格式需符合《医疗器械说明书和标签管理规定》。
- 生产制造信息:对生产过程进行简要描述。
- 符合性声明:声明产品符合备案相关法规和安全有效性要求。
- 营业执照副本。
- 提交与形式审查:在线提交后,北京市药监局将对备案资料的完整性、规范性进行形式审查。若材料齐全、符合形式要求,即予以备案。
- 获取备案凭证:审查通过后,系统自动生成 “第一类医疗器械备案凭证” 和 “备案编号” 。企业可自行在平台下载、打印电子凭证,该凭证即视为产品已备案。
四、实现“快速”的关键策略
- 事前充分准备,确保材料质量:
- 模板化与标准化:参考官方模板和同行业优秀案例编写技术文档,避免低级错误。
- 内部审核:建立跨部门(研发、质量、法规)的审核机制,在提交前彻底检查所有文件的准确性和一致性。
- 熟练掌握在线系统:指定专人负责系统操作,熟悉各项功能与填报细节,避免因操作不熟导致填报错误或退回。
- 关注官方指引与常见问题:定期查阅北京市药监局官网发布的办事指南、通知公告及常见问题解答,及时了解最新要求。
- 保持沟通渠道畅通:在备案过程中若遇到问题,可及时通过平台咨询或电话联系监管部门进行沟通。
- 同步准备生产备案:产品备案完成后,若为首次生产该产品,还需办理 “第一类医疗器械生产备案” 。两者可并行准备,但生产备案需在产品备案完成后进行。
五、备案后注意事项
- 变更备案:备案信息(如产品名称、型号规格、技术要求、说明书等)发生变化时,需及时在线提交变更备案。
- 年度报告:根据规定,备案人需每年定期向药监局提交年度报告。
- 合规生产与经营:取得备案凭证不代表监管结束,企业必须持续按照《医疗器械生产质量管理规范》的要求组织生产,确保产品安全有效。
###
在北京,国产第一类医疗器械的“注册”已全面转化为高效的线上备案制。企业实现快速上市的核心在于 “准确的分类判定” 与 “高质量的备案材料准备” 。通过充分利用数字化政务平台,提前规划、精心准备,企业完全可以实现产品的快速、合规上市,从而抓住市场机遇。务必牢记,速度应建立在坚实的合规基础之上,这才是长远发展的根本。