在医疗器械行业,产品安全有效是保障公众健康的第一道防线。对于风险程度较低、实行常规管理即可保证其安全有效的第一类医疗器械,其上市前同样需要经过严格的检测程序,以确保其质量和性能符合国家标准。在四川,所有第一类医疗器械产品在正式上市前,都必须先到指定的检测机构“过检测关”,这是产品合法进入市场的必经之路。
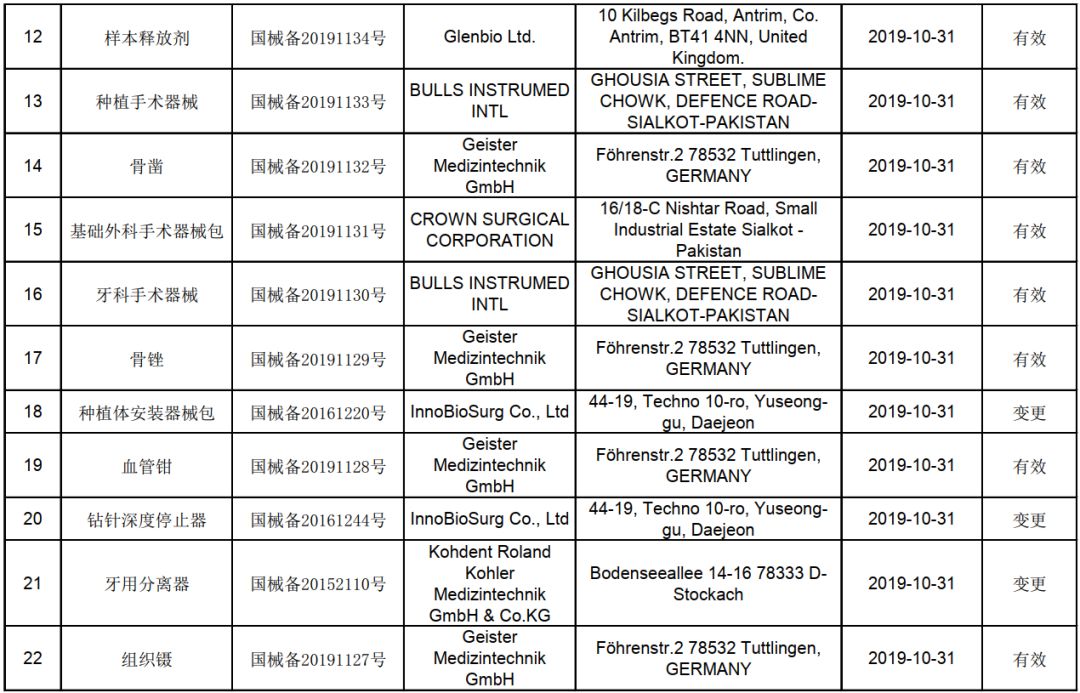
第一类医疗器械通常是指那些通过常规管理足以保证其安全性和有效性的器械,如外科用手术器械、听诊器、医用X光胶片等。尽管风险较低,但并不意味着可以放松监管。根据《医疗器械监督管理条例》规定,第一类医疗器械实行产品备案管理。备案前,产品必须符合相关的国家标准或行业标准,并经过检验合格。
在四川,承担这一重要检测任务的机构是经国家药品监督管理部门认可的医疗器械检测机构。这些机构拥有先进的检测设备和技术力量,能够对第一类医疗器械的物理性能、化学性能、生物安全性等关键指标进行全面、科学的检测。生产企业需要将产品样品送至这些机构,按照相关标准进行检测,并获得合格的检验报告。
检测过程通常包括以下几个关键环节:对产品的外观、结构、尺寸等进行初步检查;进行性能测试,确保其功能达到设计要求;再次,进行生物相容性评估,确保与人体接触时不会产生不良反应;对产品的标签、说明书等进行审核,确保信息准确、完整。只有所有检测项目均合格后,检测机构才会出具合格的检验报告。
获得合格的检测报告后,生产企业才能向四川省药品监督管理部门提交产品备案申请。备案过程中,监管部门会审核产品的检测报告、生产企业的资质证明、产品技术要求等文件。一旦备案成功,产品即获得上市资格,可以在市场上合法销售和使用。
这一严格的检测程序不仅是对消费者健康的负责,也是对企业自身发展的保障。通过检测,企业可以及时发现产品存在的潜在问题,进行改进和优化,从而提升产品质量和市场竞争力。这也是监管部门履行监管职责、维护市场秩序的重要手段。
四川对第一类医疗器械实行上市前检测制度,体现了对医疗器械安全性的高度重视。这道“检测关”是确保医疗器械安全有效的关键环节,为公众健康筑起了一道坚实的防线。生产企业应积极配合检测工作,确保产品符合标准,共同促进医疗器械行业的健康发展。