随着我国医疗器械市场的持续开放与规范,进口第一类医疗器械产品备案信息已成为行业关注的重要动态。2019年10月,相关部门公布了一批进口第一类医疗器械的备案信息,这不仅反映了我国医疗器械监管体系的不断完善,也为国内外企业提供了明确的市场准入指引。
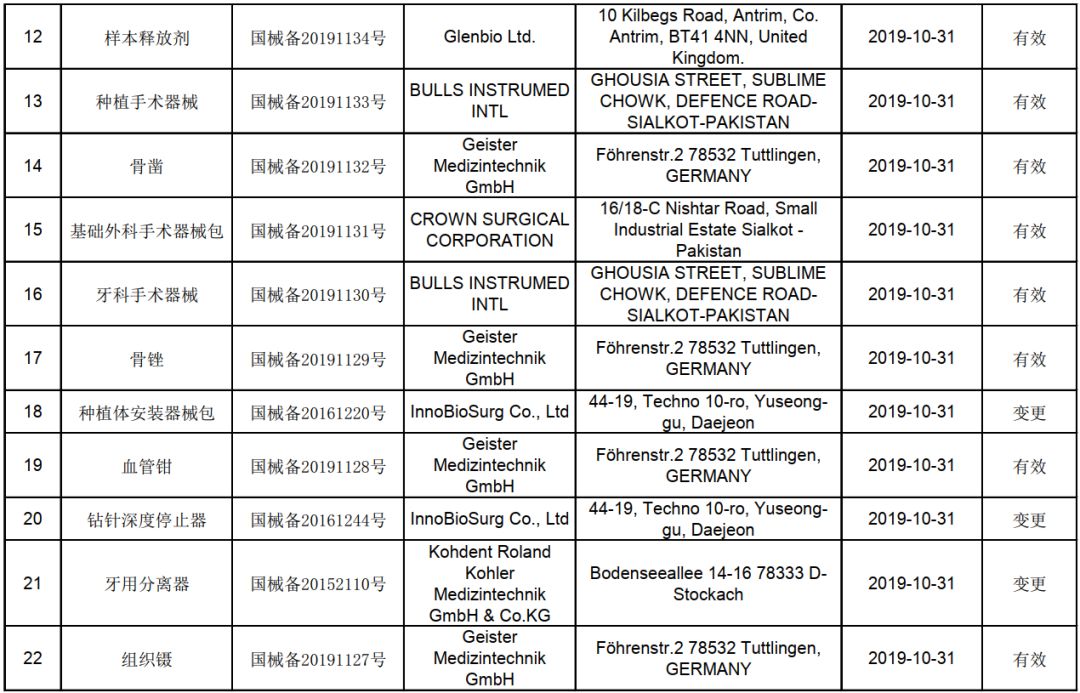
第一类医疗器械是指风险程度低,实行常规管理可以保证其安全、有效的医疗器械。对于进口产品而言,完成备案是进入中国市场的重要步骤。2019年10月的备案信息显示,当月有多项进口第一类医疗器械产品成功备案,涵盖医用耗材、诊断试剂、康复辅助器具等多个类别。这些产品大多来自美国、德国、日本等医疗器械制造强国,体现了我国市场对高质量医疗器械的旺盛需求。
从备案产品特点来看,2019年10月的进口第一类医疗器械呈现出以下趋势:一是产品技术含量较高,不少产品采用了新材料或新工艺,提升了使用安全性和便捷性;二是应用领域更加细分,针对特定医疗场景或患者群体的定制化产品增多;三是环保与可重复使用理念逐渐融入产品设计,符合全球医疗可持续发展的方向。这些趋势不仅推动了国内医疗器械行业的升级,也为患者提供了更丰富的选择。
备案信息的公开透明,有助于加强行业监督和公众知情权。企业可以通过查询备案信息了解市场竞争格局,医疗机构和消费者也能借此评估产品来源与合规性。对于进口企业而言,及时关注并遵循备案要求,是确保产品顺利投放市场的关键。2019年10月的备案数据为后续市场分析提供了宝贵参考,预示着进口医疗器械管理将更加规范化、高效化。
2019年10月的进口第一类医疗器械产品备案信息,是我国医疗器械监管国际化、标准化进程的一个缩影。随着政策的持续优化和市场的不断成熟,未来将有更多安全、有效的进口医疗器械服务于中国医疗健康事业,共同促进全民健康水平的提升。